Tung styrketræning skaber positive forandringer i det neuromuskulære system hos ældre
Casper Søndenbroe, Postdoc
- Department of Orthopedic Surgery M, Institute of Sports Medicine Copenhagen, Copenhagen University Hospital Bispebjerg and Frederiksberg, Copenhagen, Denmark.
- Center for Healthy Aging, Department of Clinical Medicine, Faculty of Health and Medical Sciences, University of Copenhagen, Copenhagen, Denmark
Korresponderende forfatter
Casper Søndenbroe, e-mail: Casper.soendenbroe@regionh.dk
Resumé
Det neuromuskulære system undergår degenerative aldersrelaterede ændringer, herunder henfald af α-motorneuroner og svækkelse af neuromuskulære forbindelser, hvilket påvirker muskelfunktionen negativt. Tab af neuromuskulær innervering, kaldet denervering, kan detekteres og kvantificeres i muskelbiopsier udtaget fra mennesker på både protein- og genniveau. I det følgende bliver et nyligt publiceret studie, omhandlende effekten af tung styrketræning på det neuromuskulære system, gennemgået og diskuteret. Overordnet tyder fundene i studiet på, at tung styrketræning af ældre mænd kan påvirke det neuromuskulære system positivt. Disse fund støtter idéen om at tung styrketræning, i højere grad end det aktuelt er tilfældet, bør anbefales til ældre personer som et værktøj til at bevare den neuromotoriske funktion bedst muligt. Flere undersøgelser af dette aspekt er dog nødvendige, hvor der også undersøges effekten af andre typer af fysisk aktivitet.
Det aldrende neuromuskulære system
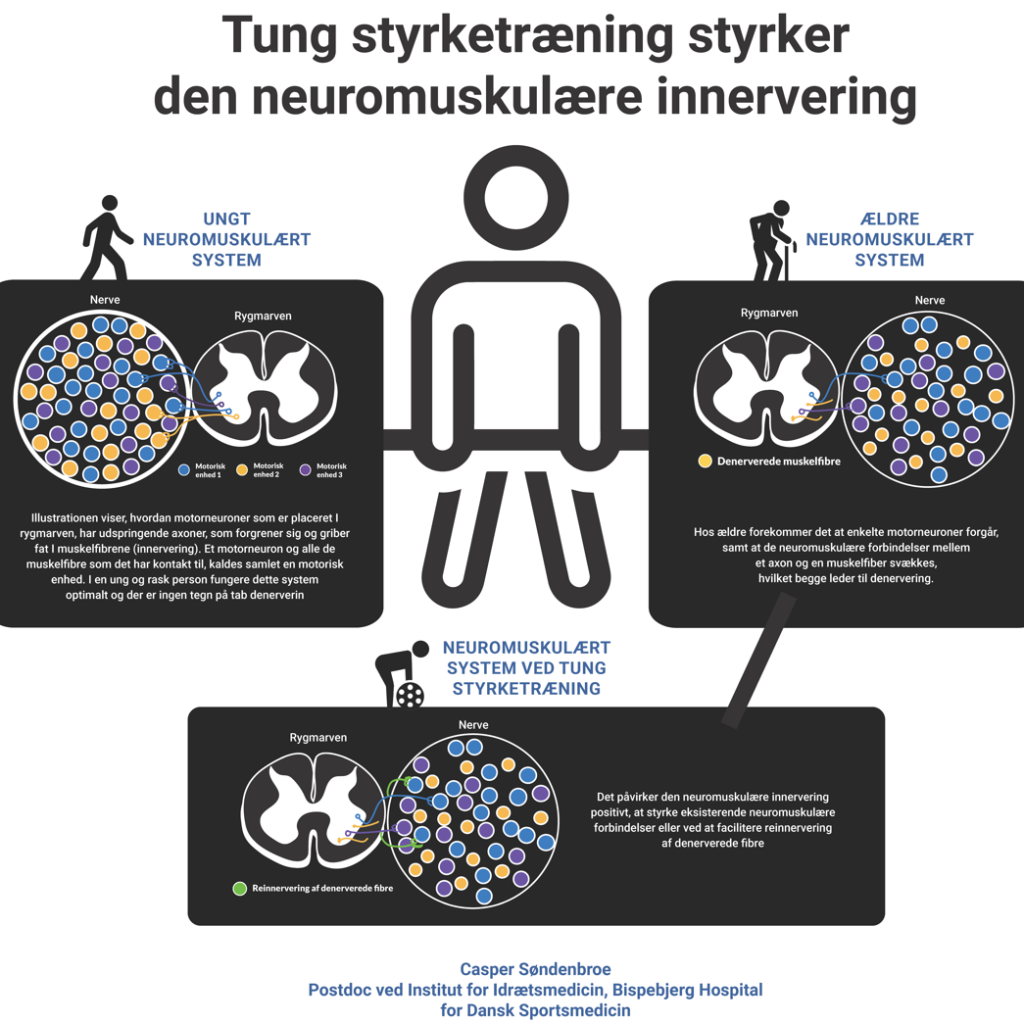
α-motorneuroner er postmitotiske celler, hvis cellekrop er placeret i rygmarvens forhorn, og som via de ventrale rødder udsender axoner til skeletmuskulaturen i hele kroppen (1). Alle muskelfibre har kontakt via et lille, afgrænset kontaktpunkt, kaldet en neuromuskulær forbindelse, til et axon og et dertil hørende α-motorneuron. Der er kun en neuromuskulær forbindelse til hver muskelfiber, og området omkring denne er distinkt fra resten af fiberen, bl.a. med klyngedannelse af acetylkolinreceptorer. Et α-motorneuron derimod har via sine axonale forgreninger kontakt til mange muskelfibre og disse betegnes tilsammen som en motorisk enhed. Antallet af muskelfibre i hver motoriske enhed varierer voldsomt fra få fibre i musklerne omkring øjnene til flere tusinde muskelfibre i de større ekstremitetsmuskler, som skal kunne generere stor kraft. På denne måde kan hjernens nervesignaler effektivt omsættes til en passende bevægelse, uanset om urmageren nænsomt sætter urskiven på plads, eller om fodboldmålmanden udfører et langt udspark.
Med alderen reduceres antallet af α-motorneuroner (2,3), hvilket resulterer i, at de muskelfibre, som tidligere var innerveret af et givent α-motorneuron, mister signalet. Denne proces kaldes muskelfiberdenervering. Der findes data, fra både dyr og mennesker, som indikerer, at de neuromuskulære forbindelser bliver svækket med alderen, hvormed transmissionen af det elektriske nerveimpulssignal i axonet, der leder til en depolarisering af muskelfiberen og dermed muskelkontraktion, ikke fungerer optimalt (4,5). Denerverede muskelfibre, uanset om årsagen er henfald af α-motorneuron eller svækkelse af den neuromuskulære forbindelse, kan i et vist omgang blive reinnerveret via såkaldt axonal sprouting fra nærliggende α-motorneuroner, hvilket formodes at være en essentiel proces i de tidlige stadier af aldringsprocessen (6). Fra studier baseret på elektromyografi er det påvist, at ældre har færre men større motoriske enheder (7,8), som konsekvens af denne denervering-reinnerverings proces. Det er samtidig interessant, at studier, som har sammenlignet livslangt træningsvante og sedentære ældre vha. elektromyografi, finder tegn på at kronisk fysisk aktivitet kan have en beskyttende effekt på α-motorneuroner (8) og samtidig promovere reinnervering (9) .
Ovenstående ændringer i det neuromuskulære system udgør nogle af de primære årsager til det aldersrelaterede tab af muskelmasse og –styrke, som er veldokumenteret i litteraturen (10–13). Klinisk relevant tab af muskelmasse kaldes sarkopeni (ICD-kode: M62-84), hvilket, afhængig af den anvendte definition, påvirker 5-10 % af alle personer >65 år og 25-40 % > 80 år (14), og medfører en række personlige og samfundsmæssige konsekvenser (15,16). Det estimeres samtidig, at både det absolutte antal og den relative andel af ældre i den vestlige verdens befolkning vil øges markant over de kommende årtier (17), hvilket skaber et behov for at etablere effektive værktøjer til at modvirke aldersrelateret tab af muskelmasse og -funktion.
Studiets design
For at undersøge om tung styrketræning beskytter mod denervering og/eller fremmer reinnervering, blev 70 ældre mænd (72±5 år) rekrutteret på baggrund af at de var raske, fri for sygdom, normalvægtige, ikke-rygere samt ikke allerede udførte hård fysisk aktivitet (18,19). Ud af de 70 personer gennemførte 58, med 38 personer allokeret via lodtrækning til træningsgruppen og 20 deltagere allokeret til kontrolgruppen, hvor sidstnævnte fortsatte deres vante livsstil.
Træningsinterventionen bestod af superviseret, tung styrketræning, udført tre gange om ugen (mandag, onsdag og fredag) i 4 måneder; i alt ~48 (interval 44-53) træningssessioner. Træningen bestod af tre underkropsøvelser (Leg press, Leg extension, Leg curl) samt to overkropsøvelser (Pulldown, Shoulder press). Træningen i de to første uger blev foretaget med et relativ højt antal gentagelser per sæt (12) og lav belastningsintensitet (15 repetitions maksimum (15RM)) og fungerede som tilvænningsperiode. Herefter blev belastningen gradvist gjort tungere til 12RM i uge 3 til 5, 10RM i uge 6 til 11 og 8RM i uge 12-16, mens den samlede træningsvolumen (sæt x gentagelser x vægt) blev opretholdt ved at øge antallet af sæt fra 3 til 4 og senere 5.
Både før, midtvejs igennem og efter interventionsperioden blev der for begge forsøgsgrupper udført styrketests af knæstrækker muskulaturen (isometrisk og isokinetisk dynamometri), foretaget magnetic resonance imaging af lårets muskulatur til bestemmelse quadriceps tværsnitsarealet samt udtaget muskelbiopsier fra vastus lateralis.
Hvad er det nye?
Træningen var effektiv; allerede midtvejs igennem interventionsperioden (2 måneder) var muskelstyrke og quadriceps tværsnitsareal øget med hhv. 16 % og 4 %, og de forblev efter interventionsperioden (4 måneder) forøget ift. før forsøget med hhv. 17 % og 5 %. Tillige var størrelsen af type II muskelfibrene forøget med 11 % efter 16 uger. Med udgangspunkt i de udtagne muskelbiopsier blev det undersøgt i hvilket omfang den neuromuskulære innervering var påvirket af perioden med tung styrketræning. Til det formål blev en række markører for muskelfiberdenervering både på protein- og genniveau anvendt (20). Når en muskelfiber mister forbindelsen til sit α-motorneuron, så ændres både protein- og genekspressionen i hele muskelfiberen, hvilket omfatter en række proteiner normalt kun observeret ved de neuromuskulære forbindelser. Det kan derfor, når muskelbiopsier undersøges, måles om der er et forhøjet niveau af disse specifikke proteiner og gener, hvilket kan tolkes som tegn på denervering. Omvendt vil et reduceret niveau eller et fald over tid indikere forbedret innervering.
Først blev andelen af muskelfibre som var positive for tre markører for denervering (neural-cell-adhesion-molecule, nestin og neonatal myosin heavy chain) undersøgt vha. immunohistokemiske farvninger og mikroskopi (se figur 1 for eksempel). Her var, i lighed med tidligere studiefund, omkring ~1% af alle muskelfibre positive for en eller flere af disse markører, men andelen ændrede sig ikke som følge af træningsinterventionen. Størstedelen af de positive fibre var kraftigt atrofierede, hvilket indikerer længerevarende denervering (21). Derudover blev genekspression for de fem acetylkolinreceptor subunits (α, β, γ, δ og ε) som findes i skeletmuskulaturen målt. Her blev det observeret, at ekspressionen af to ud af fem subunits (α og ε) var signifikant reduceret midtvejs igennem interventionsperioden (og lavere end kontrolgruppen), hvilket blev fortolket til at indikere forbedret innervering. En styrket innervering vil alt andet lige resultere i en højnet muskelfunktion, da hjernens signaler til musklerne dermed effektivt kan omsættes til bevægelse. Altså tyder det på, at når det aldrende muskelvæv undergår en høj grad af remodellering (hypertrofi, øget kontraktilitet), så udløses der parallelle forbedringer i den neuromuskulære innervering, som tidligere observeret i forsøg med mus (22).
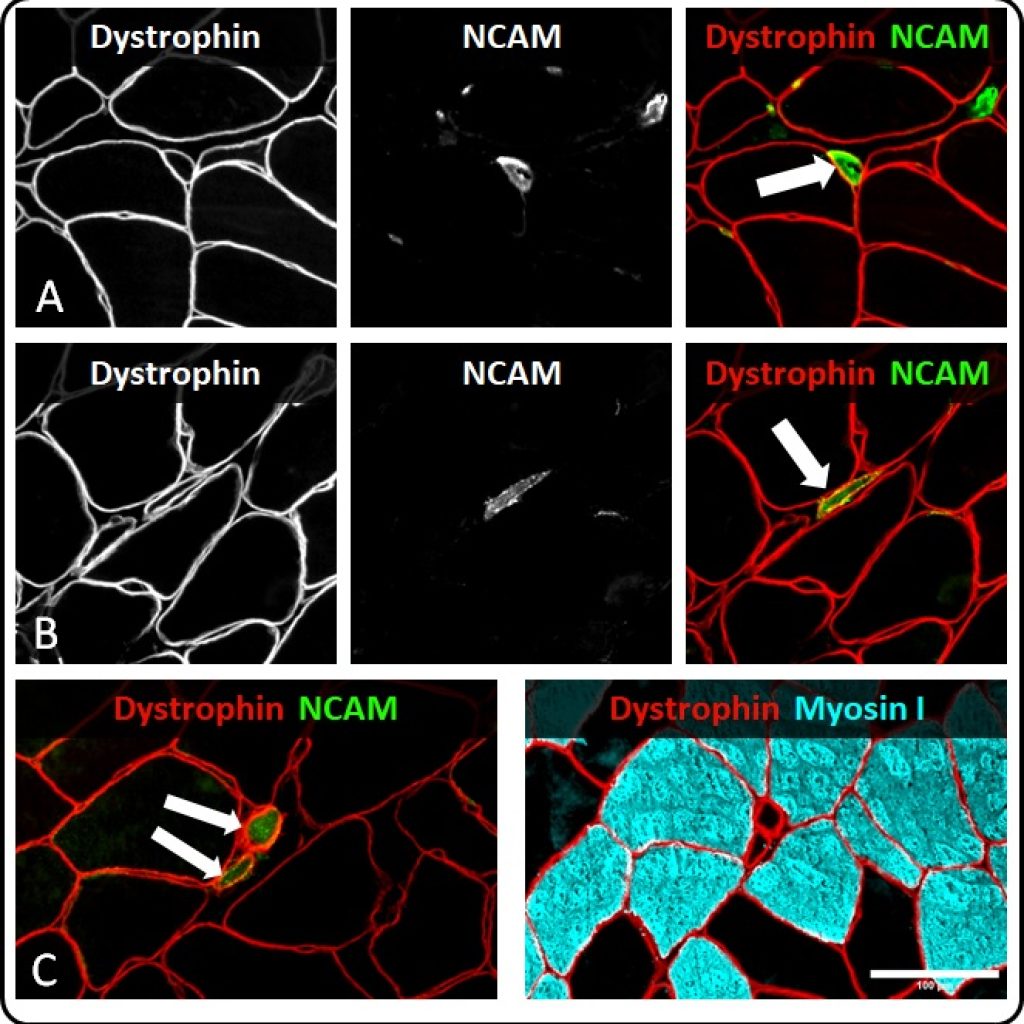
Man kan dog undre sig over, hvorfor det kun er genekspressionen for de udvalgte acetylkolinreceptor subunits og ikke også de immunohistokemiske markører for denervering, der påvirkes af træning? Først og fremmest skal det nævnes, at der var stor intra- og interindividuel variation i sidstnævnte data, hvilket selvsagt reducerer muligheden for at detektere statistisk signifikante forskelle. Derudover så er det muligt, at det ikke er de samme muskelfibre, som bidrager til signalet i to forskellige typer af analyser. Som det kan ses i figur 1, så er de fleste denerverede fibre allerede svundet meget ind (atrofierede), hvormed det kan formodes, at de har været denerverede i lang tid forinden og muligvis allerede har passeret det ultimative punkt for, hvornår en muskelfiber kan blive reinnerveret. I tillæg hertil skal det bemærkes at ældre, som tidligere nævnt, har færre men større motoriske enheder, men der synes at være en øvre grænse for antallet af muskelfibre i en sådan enhed (23). Det er derfor muligt, at nogle af de muskelfibre, som observeres i mikroskopet, omfatter fibre, som gradvist henfalder af netop denne årsag. Omvendt forholder det sig med genekspressionen af acetylkolinreceptorerne, som formodes i højere grad at repræsentere en styrkelse af neuromuskulære forbindelser i de muskelfibre, hvor disse var blot svækket.
De kliniske implikationer
De positive sundhedseffekter af generel fysisk aktivitet ift. både sygelighed og dødelighed er uomtvistelige (24), hvormed et øget niveau af fysisk aktivitet kan forventes at lede til bedre insulinfølsomhed, lavere blodtryk, bedre kondition og højere muskelstyrke – for blot at nævne nogle få vigtige aspekter. Af den årsag er det også nemt at tænke, at fundene fra indeværende studie blot er endnu ”bevis” i en lang række af ”beviser” for, hvorfor fysisk aktivitet og herunder styrketræning er noget, som bør anbefales til hele befolkningen generelt og til aldrende personer i særdeleshed (25).
Det springende punkt her er, at dette studie er det første i mennesker til at bidrage med direkte evidens for, at samspillet mellem nervesystemet og muskulaturen kan forbedres ved tung styrketræning. Det er vigtigt, at vi fortsat undersøger, nøjagtigt hvilke tilpasninger en given type af fysisk aktivitet leder til, så de anbefalinger der udstikkes, bliver så præcise og effektive som muligt, og kan tilrettes til den enkelte person eller patient. Studiet kan med rette kritiseres for kun at have inkluderet mænd og at kun styrketræning blev undersøgt, samt at de anvendte markører for denervering mangler yderligere validering. Men studiet er ikke desto mindre et vigtigt skridt på vejen for at sikre sund aldring for en stor og voksende gruppe af ældre mennesker.
Referencer
1. Stifani N. Motor neurons and the generation of spinal motor neuron diversity. Front Cell Neurosci. 2014;8:293.
2. Kawamura Y, Okazaki H, O’Brien PC, Dych PJ. Lumbar motoneurons of man: I) number and diameter histogram of alpha and gamma axons of ventral root. J Neuropathol Exp Neurol. 1977 Oct;36(5):853–60.
3. Tomlinson BE, Irving D. The numbers of limb motor neurons in the human lumbosacral cord throughout life. J Neurol Sci. 1977 Nov;34(2):213–9.
4. Hughes DC, Marcotte GR, Marshall AG, West DWD, Baehr LM, Wallace MA, et al. Age-related Differences in Dystrophin: Impact on Force Transfer Proteins, Membrane Integrity, and Neuromuscular Junction Stability. J Gerontol A Biol Sci Med Sci. 2017 May 1;72(5):640–8.
5. Baehr LM, West DWD, Marcotte G, Marshall AG, De Sousa LG, Baar K, et al. Age-related deficits in skeletal muscle recovery following disuse are associated with neuromuscular junction instability and ER stress, not impaired protein synthesis. Aging. 2016 Jan 29;8(1):127–46.
6. Hepple RT, Rice CL. Innervation and neuromuscular control in ageing skeletal muscle. J Physiol (Lond). 2016 Apr 15;594(8):1965–78.
7. Campbell MJ, McComas AJ, Petito F. Physiological changes in ageing muscles. J Neurol Neurosurg Psychiatry. 1973 Apr;36(2):174–82.
8. Power GA, Dalton BH, Behm DG, Vandervoort AA, Doherty TJ, Rice CL. Motor Unit Number Estimates in Masters Runners: Use It or Lose It? Medicine & Science in Sports & Exercise. 2010;42(9):1644–50.
9. Piasecki M, Ireland A, Piasecki J, Degens H, Stashuk DW, Swiecicka A, et al. Long-Term Endurance and Power Training May Facilitate Motor Unit Size Expansion to Compensate for Declining Motor Unit Numbers in Older Age. Front Physiol. 2019;10:449.
10. Suetta C, Haddock B, Alcazar J, Noerst T, Hansen OM, Ludvig H, et al. The Copenhagen Sarcopenia Study: lean mass, strength, power, and physical function in a Danish cohort aged 20-93 years. J Cachexia Sarcopenia Muscle. 2019 Dec;10(6):1316–29.
11. Lexell J, Taylor CC, Sjöström M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 1988 Apr;84(2–3):275–94.
12. Aagaard P, Suetta C, Caserotti P, Magnusson SP, Kjaer M. Role of the nervous system in sarcopenia and muscle atrophy with aging: strength training as a countermeasure. Scand J Med Sci Sports. 2010 Feb;20(1):49–64.
13. Manini TM, Hong SL, Clark BC. Aging and muscle: a neuron’s perspective. Curr Opin Clin Nutr Metab Care. 2013 Jan;16(1):21–6.
14. Morley JE, Anker SD, von Haehling S. Prevalence, incidence, and clinical impact of sarcopenia: facts, numbers, and epidemiology—update 2014. Journal of Cachexia, Sarcopenia and Muscle. 2014;5(4):253–9.
15. Janssen I, Shepard DS, Katzmarzyk PT, Roubenoff R. The Healthcare Costs of Sarcopenia in the United States. Journal of the American Geriatrics Society. 2004 Jan 1;52(1):80–5.
16. Reid KF, Naumova EN, Carabello RJ, Phillips EM, Fielding RA. Lower extremity muscle mass predicts functional performance in mobility-limited elders. J Nutr Health Aging. 2008 Sep 1;12(7):493.
17. United Nations Department of Economic and Social Affairs, Population Division. World Population Prospects 2022: Summary of Results. 2022. (UN DESA/POP/2022/TR/NO. 3; vol. UN DESA/POP/2022/TR/NO. 3).
18. Soendenbroe C, Flindt Heisterberg MF, Schjerling P, Kjaer M, Andersen JL, Mackey AL. Human skeletal muscle acetylcholine receptor gene expression in elderly males performing heavy resistance exercise. Am J Physiol Cell Physiol. 2022 Jun 1;
19. Heisterberg MF, Andersen JL, Schjerling P, Lund A, Dalskov S, Jønsson AO, et al. Losartan has no additive effect on the response to heavy-resistance exercise in human elderly skeletal muscle. J Appl Physiol (1985). 2018 Nov 1;125(5):1536–54.
20. Soendenbroe C, Andersen JL, Mackey AL. Muscle-nerve communication and the molecular assessment of human skeletal muscle denervation with aging. American Journal of Physiology-Cell Physiology. 2021 Aug 1;321(2):C317–29.
21. Viguie CA, Lu DX, Huang SK, Rengen H, Carlson BM. Quantitative study of the effects of long-term denervation on the extensor digitorum longus muscle of the rat. The Anatomical Record. 1997 Jul;248(3):346–54.
22. Valdez G, Tapia JC, Kang H, Clemenson GD, Gage FH, Lichtman JW, et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci U S A. 2010 Aug 17;107(33):14863–8.
23. Allen MD, Dalton BH, Gilmore KJ, McNeil CJ, Doherty TJ, Rice CL, et al. Neuroprotective effects of exercise on the aging human neuromuscular system. Experimental Gerontology. 2021 Sep;152:111465.
24. Warburton DER, Bredin SSD. Health benefits of physical activity: a systematic review of current systematic reviews. Curr Opin Cardiol. 2017 Sep;32(5):541–56.
25. Sundhedsstyrelsen. Fysisk Aktivitet: Håndbog om forebyggelse og behandling. 2018.